Terapia genetica per il mercato delle malattie rare - Insights
La terapia genetica comporta l'inserimento di materiale genetico nelle cellule dei pazienti per fornire nuova funzione o ripristinare il funzionamento mancante o inappropriato delle cellule a causa di tumori o mutazioni genetiche. Secondo il National Center for Advancing Translational Sciences, anche se sono identificate circa 7.000 malattie rare, solo poche centinaia hanno approvato i trattamenti. Inoltre, lo sviluppo della terapia genica per malattie rare sta acquisendo una trazione significativa, poiché più dell'80% delle malattie rare hanno una causa monogenica nota (single-gene). I piccoli farmaci molecolari spesso trattano i sintomi solo piuttosto che curare la causa sottostante della malattia. Ciò richiede la somministrazione frequente dei farmaci per gestire la condizione. La terapia genetica ha il potenziale di correggere i difetti genetici sottostanti. Inoltre, un suono clinicamente e di successo terapia genica può solo richiedere una singola dose per curare una malattia piuttosto che richiedere un trattamento a vita. Terapie geniche approvate commercialmente includono Kymriah (Novartis AG), Yescarta (Gilead Sciences, Inc.), Luxturna (Spark Therapeutics), e Strimvelis (Orchard Therapeutics).
Aumentare le approvazioni e i lanci di nuove terapie geniche per il trattamento di varie malattie rare si prevede di aumentare la terapia genica per la crescita del mercato delle malattie rare nel periodo previsto
In passato, i principali attori del mercato hanno ottenuto le approvazioni normative e hanno lanciato le loro terapie sul mercato. Le frequenti approvazioni di nuove terapie geniche e i loro lanci nelle regioni sviluppate sono tenuti a guidare significativamente la terapia genica per la crescita del mercato delle malattie rare nel periodo di previsione. Per esempio, nel dicembre 2017, Spark Therapeutics, Inc. ha ricevuto l'approvazione dell'US Food and Drug Administration (FDA) per la sua LUXTURNA (voretigene neparvovec-rzyl), un prodotto di terapia genica di una volta indicato per il trattamento dei pazienti con distrofia retinica associata alla mutazione biallelica RPE65. Inoltre, nell’agosto 2018, Novartis International AG ha ricevuto l’approvazione della Commissione Europea (CE) per Kymriah (tisagenlecleucel, precedentemente CTL019) indicata per il trattamento dei pazienti fino a 25 anni di età con recidiva o refrattaria B-cellula acuta leucemia (ALL) e per il trattamento di pazienti adulti con recidiva o refrattaria (r/r) diffuso grandi linee B-cellula. Inoltre, nell'agosto 2018, Kite Pharma, Inc., una Gilead Company, ha ricevuto l'approvazione di Marketing della Commissione Europea (EC) per il suo romanzo Yescarta (axicabtagene ciloleucel), come trattamento per i pazienti adulti con recidiva o refrattario diffuso grande linfoma B-cell (DLBCL) e principale linfoma B-cell (PMBCL), dopo due o più linee di sistematica.
La terapia genica globale per le dimensioni del mercato delle malattie rare è stata valutata 16,3 milioni di dollari nel 2017, e si prevede di assistere ad una robusta CAGR di 35.0% rispetto al periodo previsto (2018-2026).
Figura n.1: Terapia Genetica Globale per il Mercato delle Malattie Rare Condividi, Per Droga (%), 2018 -2026 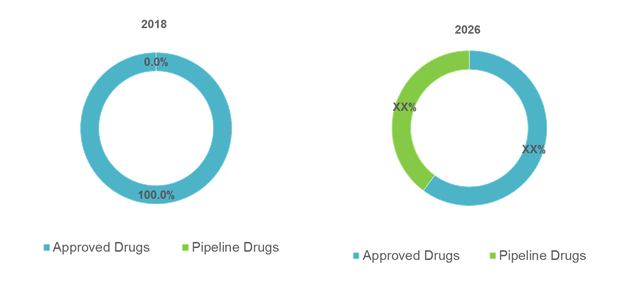
Per saperne di più su questo report, richiedi copia campione
Fonte: Analisi delle prospettive di mercato coerenti (2018)
La ricerca e lo sviluppo in corso nelle terapie geniche per le malattie rare dovrebbe aumentare la crescita della terapia genica globale per il mercato delle malattie rare
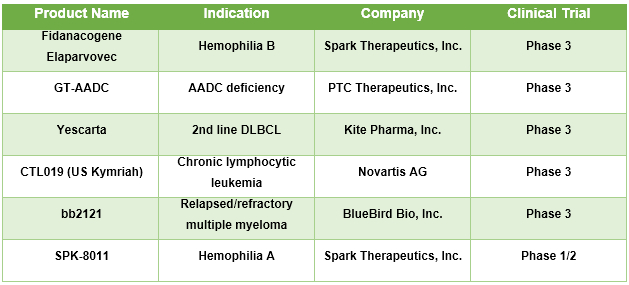
Presenza di terapie geniche multiple per vari trattamenti di malattie rare in pipeline, che si prevede di ottenere l'approvazione è previsto per aumentare la crescita del mercato nel periodo di previsione. Per esempio, Spark Therapeutics, Inc. sta sviluppando la terapia genica: Fidanacogene Elaparvovec, una nuova terapia genica investigativa indicata per il trattamento dei pazienti affetti da emofilia B. Attualmente, la terapia è sotto la fase 3 clinica e si prevede di ricevere l'approvazione in un prossimo futuro. Nell'agosto 2018, uniQure N.V. ha trattato il primo paziente nel suo Studio di conferma della dose di Fase IIb di AMT-061, una terapia genica a base di AAV5 che incorpora la variante FIX-Padua per il trattamento dei pazienti con emofilia grave e moderatamente grave B. Nel maggio 2018, Orchard Therapeutics Plc. ha ricevuto Rare Pediatric Disease Designation dalla U.S. Food and Drug Administration (FDA) per il suo candidato di terapia genica indicato OTL-200 PTC Terapeutica, In. ha GT-AADC nella fase 3 studi clinici ed è indicato per la carenza di Aromatic L-Amino Acid Decarboxylase (AADC).
Tabella No.1: Terapia Genetica per la Pipeline Malattia Rara
Per saperne di più su questo report, richiedi copia campione
Fonte: Siti web aziendali, Clinicaltrials.gov
Tuttavia, la mancanza di consapevolezza tra la popolazione per quanto riguarda le malattie rare e il loro trattamento è previsto per influenzare negativamente la crescita della terapia genica per il mercato delle malattie rare. Per esempio, nel 2017, uniQure N.V. ha abbandonato la loro pianta per perseguire il rinnovamento della sua terapia genica Glybera, che è stata approvata nel 2012, per il trattamento di un piccolo sottoinsieme di pazienti con carenza di lipasi di lipoproteina familiare (LPLD). La società ha abbandonato il loro piano a causa della domanda molto bassa di terapia sul mercato
Alcuni dei principali attori operanti nella terapia genica globale per il mercato delle malattie rare includono Kite Pharma, Inc. (Gilead Sciences, Inc.), Novartis International AG, Juno Therapeutics Inc. (Celgene Corporation), Bluebird Bio, Inc., Spark Therapeutics, Inc., uniQure N.V, Orchard Therapeutics Plc., PTC Therapeutics, Inc.
Condividi
Ti manca la comodità di leggere un report nella tua lingua locale? Trova la tua lingua preferita:
Trasforma la tua strategia con report sulle tendenze esclusivi:
Frequently Asked Questions
Unisciti a migliaia di aziende in tutto il mondo impegnate a fareng the Excellent Business Solutions..
Visualizza tutti i nostri clienti