バイオプロセス検証市場は、USD 554.8で評価されると推定される 2025年のMnはUSD 1,060.7に達すると予想される 2032年、2025年から2032年にかけて9.7%の化合物年間成長率(CAGR)を展示。 バイオプロセスの検証は、実証のプロセスを指し、バイオ医薬品製造プロセスを一貫して確実に製造し、品質基準と規制要件を満たす製品を製造することを保証します。 重要なプロセスパラメータ、機器、分析試験方法、清掃手順、コンピュータシステム、および施設の検証を含みます。 バイオプロセスの検証は、薬の安全性、有効性、品質を保証するために重要です。 バイオプロセスの検証の市場成長を後押しする主要な運転者は医薬品およびバイオテクノロジーの企業の研究開発の投資の増加、成長を含んでいます バイオシミラーとバイオロジック 他者の間で市場、好ましい政府の規則。
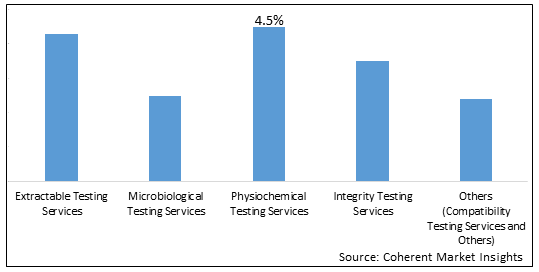
バイオプロセス検証市場は、テストタイプ、プロセスタイプ、エンドユーザーと地域別に分けられます。 テストタイプによって、市場は抽出可能なテスト サービス、微生物学的テスト サービス、physiochemical テスト サービス、完全性テスト サービスおよび他に区分されます。 2025年に最大のシェアを占めるテストタイプセグメント。 これは、バイオリアクターなどのバイオプロセス機器の高い採用に起因する クロマトグラフィー 製造プロセスの有効化のためのバイオ医薬品会社によるシステム。
アナリストビュー:
- バイオプロセスの検証市場は、今後数年にわたって大幅に成長するために表彰されます。 現在、北米と欧州は、バイオプロセス検証のための厳格な規制要件による市場を支配しています。 しかし、中国、インド、韓国などの国でバイオシミラーやバイオロジックの製造能力を拡充し、アジアパシフィックは最速成長を期待しています。
- 市場はさまざまな慢性疾患の治療のためのモノクローナル抗体および組換え蛋白質の増加の採用によって主に運転されます。 バイオプロセスが高度で複雑になるにつれて、これらのプロセスの徹底的な検証の必要性は引き続き上昇します。 さらに、規制機関からの継続的なサポートにより、製品の品質と安全性がバイオプロセス検証ソリューションの採用を促進します。
- しかし、市場は検証手順に関連した高いコストから拘束にも直面しています。 訓練された専門家の欠如と相まって検証プロトコルを確立し、さらなる課題をポーズします。
- それにもかかわらず、細胞療法および遺伝子療法の出現は市場の主要な成長の機会を示します。 契約サービスプロバイダは、継続的なプロセス監視とリアルタイムリリーステストのためのデジタルツールを統合することに焦点を当てています。 高度な分析とモデリング技術を採用することで、バイオプロセスを最適化し、タイムリーな製品承認を容易にすることができます。 全体的に、増加するバイオ医薬品研究開発の支出と成長は一貫したプロセス性能を確保するための必要性で、バイオプロセス検証ソリューションの需要は、今後大幅に増加することが期待されます
バイオプロセス検証市場 地域 洞察:
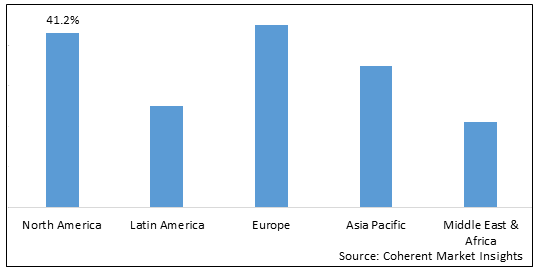
- 北アメリカ 予測期間中のバイオプロセス検証のための最大の市場であることが期待されます, 会計オーバー 2025年の市場シェアの2%お問い合わせ 北アメリカの市場の成長は、主要なバイオ医薬品会社、高研究開発投資、および地域におけるバイオプロセス検証のための厳格な規制要件の存在に起因する。
- ヨーロッパ バイオプロセス検証のための第2位の市場であることが期待されます, オーバーのための会計 2025年の市場シェアの5%お問い合わせ 地域における市場の成長は、バイオ生産活動の増加、ライフサイエンス研究の普及、および欧州における有利な政府の資金の普及につながる可能性があります。
- アジアパシフィック バイオプロセス検証のための最速成長市場であることが期待され、展示 予測期間の19.3%を超えるCAGRお問い合わせ アジアパシフィックの市場拡大は、バイオ医薬品製造部門の拡大、研究開発インフラへの投資の増加、地域におけるアウトソーシングサービスの急激な成長に寄与しています。
プロフィール 1.グローバルバイオプロセス検証市場シェア(%)、地域別、2025
このレポートの詳細, サンプル コピーをリクエスト
バイオプロセス検証市場ドライバー:
- バイオ医薬品の研究開発投資の増加: バイオ医薬品業界は、過去10年間に研究開発費の大きな成長を目撃してきました。 いくつかのバイオ医薬品会社は、新規バイオ医薬品およびバイオシミラーの開発に焦点を合わせ、堅牢な臨床パイプラインを持っています。 バイオロジック医薬品開発が進んでいるため、前処理と臨床製造における広範なプロセス特性評価と検証の必要性が高まっています。 また、細胞や遺伝子治療などの新規品種のバイオプロセスの複雑性は、薬物の安全性と有効性を確保するために、より大きな検証の一貫性を必要とします。
- バイオ医薬品およびバイオシミラー市場の成長: バイオ医薬品およびバイオシミラー向けの急速に拡大する市場は、バイオプロセスの検証活動を行う主要な要因です。 がんおよび自己免疫疾患に対する高値の生態学の承認は、業界全体のさらなるエスカレーションされた生体生産量を持っています。 これは、検証された製造プロセスと分析のための重要な需要を創出し、シームレスなスケールアップと製品品質コンプライアンスを保証します。
- バイオ医薬品会社によるアウトソーシングの増加: 多くのバイオ医薬品会社は、契約会社への検証サービスを含む、様々なバイオ処理活動を戦略的にアウトソーシングしています。 受託製造組織(CMO)は、スポンサーのプロセスや製品に対するエンドツーエンドの検証サポートを提供するために、サービス提供を強化しています。 さらに、CMOが規定する検証プロトコルを設計・実装する専門知識は、スポンサーがよりますますアウトソーシングを活用することを奨励しています。
- 成長するバイオプロセスインフラ投資: 基質的な投資は高度の生物処理設備を造り、製造の容量を増強するためにbiopharmaの会社によってなされます。 API およびバイオロジックの生産能力の拡大は、重要な検証要件が必要です。 さらに、従来型の設備を整備し、工程の効率性を高めるため、設備・方法・インフラの有効化が求められます。 これは、バイオプロセス検証の需要に著しく貢献しています。 また、市場プレイヤーは新しいリソースセンターを立ち上げるための投資を行っており、予測期間にわたってグローバルバイオプロセス検証市場の成長を促すことが期待されています。 たとえば、2022年、Qosinaは、OEM単用部品を医療および製薬業界にグローバルサプライヤーとして、バイオプロセス業界向けの情報源である新しいBioprocess Resource Centerを立ち上げました。
バイオプロセス検証市場レポートカバレッジ
| レポートカバレッジ | ニュース | ||
|---|---|---|---|
| 基礎年: | 2024年(2024年) | 2025年の市場規模: | 米ドル 554.8 Mn |
| 履歴データ: | 2020年~2024年 | 予測期間: | 2025 へ 2032 |
| 予測期間 2025〜2032 CAGR: | 9.7% | 2032年 価値の投射: | 米ドル 1,060.7 Mn |
| 覆われる幾何学: |
| ||
| カバーされる区分: |
| ||
| 対象会社: | サルトリアス・ステディム・バイオテクノロジー、メルク・カーガ、パレル株式会社、コベター・ファイラレーション・機器、トキシコン株式会社、DOC S.r.l.、MEISSNER FILTRATION PRODUCTS、Thermal Fisher Scientific、SGS SA、Eurofins Scientific、Lonza Group、ProBioGen AG、Charles River Laboratories、Pacific BioLabxis、Gibbraltar Laboratories、Nelson Laboratories、BioProcess Technology Consulting Holdings、CMICICAL Co.、Cytologic、Cy、Cytologic、Cytologic、Cy、Cy、Cytologic、Cy、Cy、Cy、Cy、Cy、Cy、Cy、Cy、Cy、Cy、Cy、Cy、Cy、Cy、Cy、Cy、Cy、Cy、Cy、Cy、Cy、Cy、Cy、Cy、Cy、Cy、Cy、Cy、Cy、Cy、Cy、Cy、Cy、Cy、Cy、C | ||
| 成長の運転者: |
| ||
| 拘束と挑戦: |
| ||
75 以上のパラメータで検証されたマクロとミクロを明らかにする, レポートにすぐにアクセス
バイオプロセス検証市場 機会:
- オートメーションとデータ分析: ロボティクスやインターコネクテッドIoTシステムなどのオートメーション技術は、バイオプロセスの検証活動の最適化と加速のための膨大な機会を提供します。 高度な分析と自動化の組み合わせにより、監視を強化し、継続的な検証を容易にし、検証中に迅速なデータ主導の意思決定を可能にします。 ブロックチェーンなどのデータ管理技術は、アウトソーシングパートナー間でのデータセキュリティと透明性を促進します。
- シングルユースシステム統合: シングルユース技術は、柔軟性、コストの削減、およびより迅速な導入など、バイオプロセスのオウイングにおける採用の増加を目撃しています。 シングルユースコンポーネントを重要なプロセスステップに統合することで、より高速で効率的な検証が可能になります。 また、シングルユースシステムのモジュール性により、新しい使い捨てコンポーネントが既存の検証済みのプロセスに導入されると、追加の検証が可能になります。
- 仮想化とシリコモデリング: サイリコモデリングツールでは、最適化とトラブルシューティングのために、デジタルプロセスのシミュレーションを可能にします。 メカニスティックモデルと人工知能を用いた仮想検証により、広範囲にわたるリアルタイムの物理試験に対する依存性を潜在的に低下させることができます。 製造プロセスをデジタル化することにより、バイオファーマのプレイヤーは検証プロトコルを精製し、エッジケースに物理的に実行することができます。 生産性とスピードを大幅に向上させることができます。
- 協力的パートナーシップ: バイオ処理会社は、技術プロバイダー、CMO、研究所、および研究機関との戦略的パートナーシップを結んでいます。 コラボレーションフレームワークにより、パートナーの専門的専門知識とインフラを活用し、方法開発、特性分析、自動化統合、その他の検証ニーズに対応できます。
バイオプロセス検証市場 トレンド:
- ディジット化とペーパーレス検証: 重要な傾向は、自動化、電子ログブック、専門ITインフラを活用したペーパーレス検証に向けた動きです。 デジタルツールは、バリデーションのライフサイクルデータを安全かつ確実に管理できます。 また、クロスファンクションチーム間の履歴記録やリアルタイム情報共有のアクセシビリティを高め、継続的な検証をサポートします。
- デザイン(QbD)の原則によって質を採用します: Biopharmaの会社は検証のための設計アプローチによって質の使用を増加しています。 QbDは、制御戦略を確立し、設計スペースを定義するためのより深いプロセス理解を容易にし、一貫した品質を確保します。 リアルタイムリリースによるこの科学ベースの方法論は、コンプライアンスの実証から継続的なプロセス検証への移行を可能にします。
- 高められた分析のテスト: 高解像質量分析ツールは、検証中に生化学的特性、不純物および劣化製品を特徴付けるための牽引を得ています。 また、ホストセルDNAや残留タンパク質などの重要な品質属性の定量化に特化した分析アッセイキットを開発しています。
- 規制遵守を組み合わせる: バイオ医薬品会社は、複数の規制当局とのコンビネーションを可能にするために、プロセスのより統合された品質と検証戦略を採用しています。 統一された検証プロトコルは、FDA、EMA、ICHガイドラインの要件を満たす品質リスク管理原則を使用して設計されています。
バイオプロセスの検証の市場の抑制:
- 高資本投資要件: 包括的なバイオプロセス検証は、高度な機器、自動化システム、ITインフラを備えた設備を装備する重要な投資を必要とします。 より小さいバイオ医薬品選手やスタートアップは、大規模な検証支出の十分な資本を持っていないかもしれません。 これにより、検証済みのプロセスを実装し、成長機会を制限することを防ぐことができます。
- 長いプロダクト承認のタイムライン: 技術の転送活動とともにバイオプロセスのエンドツーエンド検証は、数ヶ月でバイオロジックの規制承認タイムラインを延長することができます。 広範な試験では、プロセスを非常に扱いやすく最適化するために変更を導入しています。 その結果、長い製品発売のタイムラインは、メーカーの成長の可能性を制限することができます。
- 新興市場のための未定義の規制: 中国、ブラジル、韓国などの高成長新興市場でのバイオプロセス検証のための規制の期待を回避する不確実性は、メーカーの課題をポーズします。 未定義の検証規範は、企業がこれらの市場を拡大するときに、現地の要件を順守するために、プロセスを再検証するために追加のコストを負担する。
最近の開発:
新しいプロダクト進水:
- 2019年1月1日 サルトリアス・ステディム・バイオテクノロジー、生物医薬品産業および実験室のための解決を提供する国際的な薬剤および実験室装置製造者、開始されたambr 250モジュラー、細胞ラインスクリーニング、プロセス最適化およびスケールアップの模倣のような生物プロセス開発の適用のための自動化された小型バイオリアクター システム
買収とパートナーシップ:
- 2021年1月、Sartorius AGは、バイオ医薬品研究および産業のための国際パートナーとして、GMPグレードの細胞培養成分の世界的なサプライヤーであるCellGenixの株式を買収し、細胞培養媒体ポートフォリオを拡大
- 2020年6月、 サーモフィッシャー科学、バイオテクノロジー企業、ウイルスベクトルCDMO、細胞および遺伝子治療の開発および製造のための機能を拡大するためにHenogenを、得ました
プロフィール 2. 世界のバイオプロセス検証市場シェア(%)、テストの種類、2025
このレポートの詳細, サンプル コピーをリクエスト
バイオプロセス検証市場におけるトップ企業:
- サルトリアス・ステディム・バイオテクノロジー
- メルク KGaA
- Pallコーポレーション
- Cobetterのろ過装置
- 株式会社トキシコン
- DOC S.r.l. ドキュメント
- MEISSNERフィルター製品
- サーモフィッシャー科学
- SGSのSA
- ユーロフィン科学
- ロンザグループ
- プロバイオジェンAG
- チャールズ・リバー研究所
- パシフィックバイオラボ
- ジブラルタル研究所
- ネルソン研究所
- バイオプロセス技術コンサルタント
- 株式会社CMICホールディングス
- Cytovance バイオロジック
- 無錫バイオロジック
*定義: バイオプロセスの検証は、臨床薬理学的プロセスを一貫して確実に生成し、あらかじめ決められた仕様と品質基準を満たす製品を製造するという文書化された証拠と保証を意味します。 設備、設備、ユーティリティ、プロセス、分析試験方法、自動化システムなど、生体生産の重要なすべての側面を良好な製造慣行と規制ガイドラインとして検証することを含みます。 バイオプロセスの検証は、バイオロジックの製造の重要な部分であり、製品の品質、有効性、安全性を確保するために不可欠です。 製造プロセスが分散をなくし、一貫して高品質の出力を提供するという自信を築きます。
バイオテクノロジーに関するその他の有望なレポート 業界:
著者について
Nikhilesh Ravindra Patel は、8 年以上のコンサルティング経験を持つシニア コンサルタントです。市場予測、市場インサイト、トレンドと機会の特定に優れています。市場動向に対する深い理解と成長分野を正確に特定する能力により、情報に基づいたビジネス上の意思決定をクライアントに導く上で、彼は非常に貴重な存在となっています。レポートを通じて、市場情報、ビジネス情報、競合情報サービスを提供する上で重要な役割を果たしています。
独占トレンドレポートで戦略を変革:
よくある質問


