抗糖尿病バイオシミラー市場規模と予測 – 2026 – 2033
グローバル抗糖尿病バイオシミラー 市場規模は2026年にUSD 5.8億で評価され、2033年までにUSD 13.4億ドルに達すると予想され、2026年から2033年までの12.5%の化合物の年間成長率(CAGR)を展示しています。
プロフィール
抗糖尿病剤 バイオシミラー 市場は、上昇する世界的な優先順位のために着実に拡大しています 糖尿病 そして費用効果が大きい生物的療法のための成長した要求。 インシュリンおよび他の抗糖尿病の生物的論理の生物類似体は処置の費用を減らし、忍耐強いアクセスを改善する間参照プロダクトに同等の効力そして安全を提供します。 市場成長は、主要なバイオ医薬品、有利な規制経路、および新興国におけるヘルスケア支出の増加の特許調査によってサポートされています。 主要なプレーヤーはプロダクト開発および全体的な承認に投資しています。 しかし、規制の複雑性、医師の受け入れ、製造コストなどの課題は、市場導入に影響を及ぼす。
キーテイクアウト
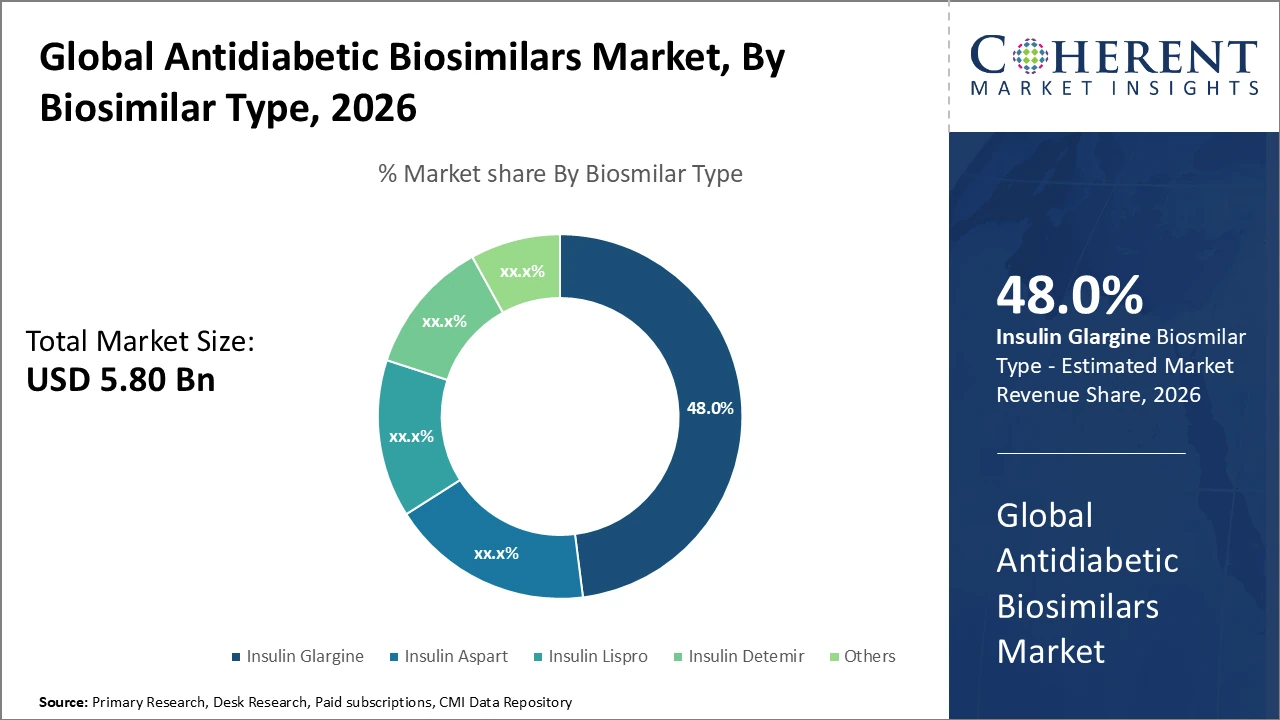
インシュリンGlargineサブセグメントは、広範囲にわたる臨床導入と市場拡大をサポートする複数のバイオシミラーの可用性によって駆動され、48%で最大の収益シェアを保持しています。
タイプ2糖尿病の塗布は処置の選択の病気の prevalence および連続的な進歩を高めることによって燃料を供給される最も急速に成長する区分を表します。
病院薬局は、一定の収入生成と広範な患者アクセスを確保し、優勢な分布チャネルを維持します。
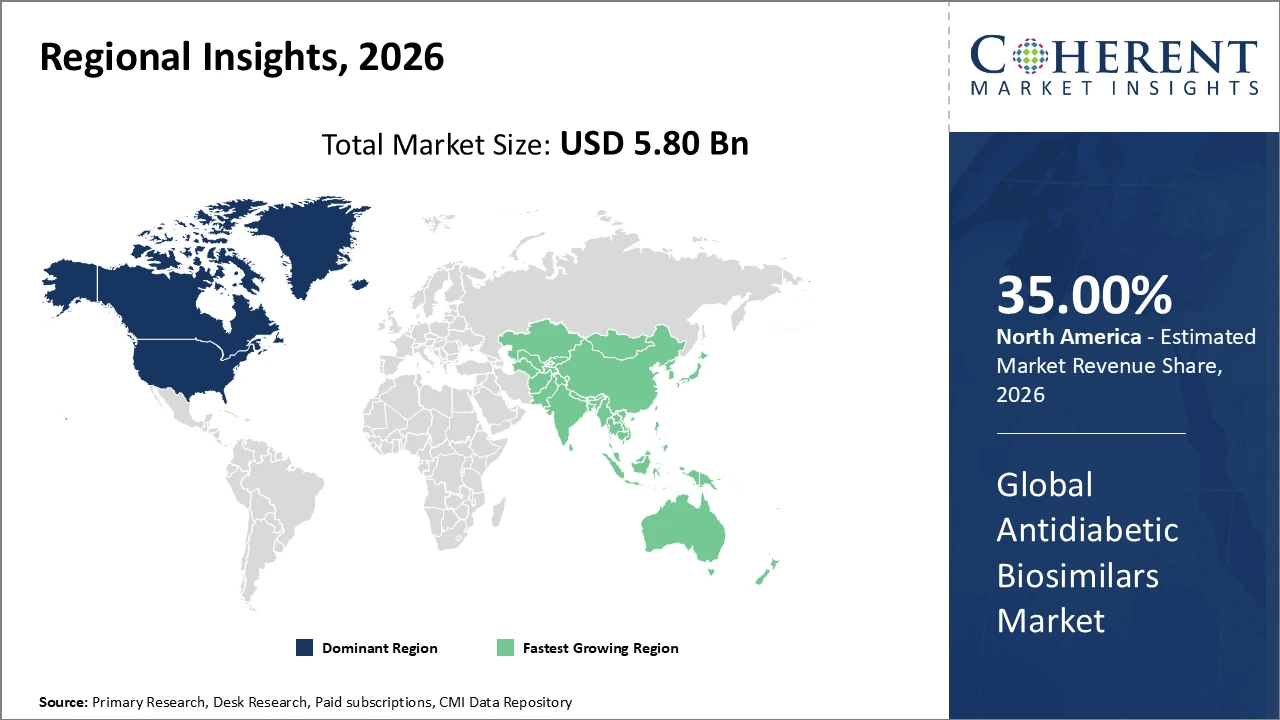
北アメリカは強い企業の存在および好ましい償還のフレームワークによって支えられる35%のシェア上の市場を、導きます。
アジアパシフィックは、人口増加とヘルスケアインフラの整備により、成長率が最も速い地域です。
ヨーロッパは、成熟した市場、持続的な需要、および規制調和から恩恵を受ける安定した成長を示しています。
抗糖尿病バイオシミラー市場セグメンテーション分析
このレポートの詳細, サンプル コピーをリクエスト
Antidiabetic Biosimilarsの市場洞察、Biosimilarのタイプによる
Insulin Glargineは、広範な臨床使用と世界的なバイオシミラーオプションの幅広い可用性のために、市場シェアを支配します。 それはその基礎インシュリンの特性のために、糖尿病患者のための一貫した、長期作用のグルコース制御を提供します。 インシュリンアスパート 強力なプルアンジアルグルコース制御によって駆動され、タイプ1とタイプ2糖尿病の併用療法における採用の増加が最も急速に成長しているサブセグメントを表します。 インシュリン・リスプロ、インシュリン・デテミール、およびより小さい市場のための他の生物シミラーの記述は、適用範囲が広い投薬の選択を提供し、治療上の利点を目標にし、忍耐強い付着力を改善することによって重要な役割を担います。
Antidiabetic Biosimilarsの市場洞察、適用によって
タイプ2 糖尿病は、ますますバイオシミラーを好む増加する世界的な糖尿病人口および進化する処置の議定書による最も速い成長を表わします。 このセグメントは、拡大したスクリーニングプログラムと早期の介入戦略から恩恵を受け、市場収益への大きな貢献を補強します。 タイプ1糖尿病は、主に長期インシュリン依存症に取り組むバイオシミラーと、安定したが小さい市場シェアを保持しています。 他のセグメント, 妊娠糖尿病とより少ない一般的な糖尿病条件を含む, 市場参加者のための限られたまだ安定した成長機会を提示します.
Antidiabetic Biosimilarsの市場洞察、エンド ユーザーによる
病院の薬局は管理されたヘルスケア設定内の集中された調達システムおよび処方優位による収益の市場を導きます。 それは入院および外来の心配のためのbiosimilarsの信頼できる可用性を保障します。 オンライン薬局は、最も急速に成長しているサブセグメントです。, テレヘルスサービスの拡張と家庭の配信のための消費者の好みの増加によって駆動, 特にポスト-2024 パンデミック適応. リテールファーマシーは、都市部や半都市部の便利なアクセスを提供することで、重要で伝統的な役割を担っています。 その他のセグメントには、専門薬局や機関販売チャネルが含まれており、追加および補完的な市場リーチを提供します。
抗糖尿病バイオシミラー市場動向
慢性疾患管理におけるバイオシミラーの浸透の増加は、治療の手頃な価格とコスト効率を向上させることで、市場ダイナミクスを再構築しています。
ブラジルやインドなどの新興市場で2024年にバイオシミラーインスリンの承認を加速させ、患者のアクセスが大幅に拡大しました。
成長する持続可能性の懸念は、開発フェーズにおける炭素排出量の20%削減を示す2025のレポートで、バイオ合成プロセスを最適化するためにメーカーを促しています。
バイオシミラー療法によるデジタルヘルスソリューションの統合は、遠隔地および保護地域におけるより広いバイオシミラーの採用をサポートするテレメディシンプラットフォームとして、勢いを増加しています。
これらのトレンドは、アクセシビリティ、サステイナビリティ、ヘルスケアのデジタル化による進化した市場景観を集約的に反映します。
Antidiabetic Biosimilarsの市場洞察、地理によって
このレポートの詳細, サンプル コピーをリクエスト
北米抗糖尿病バイオシミラー市場分析と傾向
抗糖尿病バイオシミラー市場における北アメリカのリーダーシップは、高度な医療インフラ、十分に確立された払い戻しシステム、手頃な価格の治療オプションを求める大規模な糖尿病人口によって駆動されます。 米国だけでは、バイオシミラーローンチが最大30%のインスリン療法コストを削減したNovao NordiskやEli Lillyなどの主要企業からの強力な参加でサポートし、グローバル市場の25%以上を占めています。 研究開発の継続的な投資、バイオシミラーの承認を合理化し、さらに北米の優位性と持続的な市場成長を強化する有利なFDAポリシーと共に。
アジアパシフィック抗糖尿病バイオシミラー市場分析とトレンド
一方、アジア太平洋地域は、ヘルスケアアクセスを拡大し、糖尿病の蔓延を増加させ、バイオシミラーの採用のためのより強い政府支援によって運転され、抗糖尿病バイオシミラー市場で最速の成長を示しています。 地域は、14%を超えるCAGRの登録を予定しており、インドと中国は大きな患者集団による成長をリードし、健康意識を高めています。 BioconやDr. Reddyの研究所などの地域プレーヤーは、コスト効率の高い製造能力を活用し、進化する規制枠組みから恩恵を受け、新興市場におけるアジアパシフィックの主要成長拠点として位置付けることで、重要な役割を果たしています。
重要な国のためのAntidiabetic Biosimilarsの市場見通し
米国抗糖尿病バイオシミラー市場分析とトレンド
米国の市場は、高糖尿病の予防と、バイオシミラーの採用を促進する高度な医療払い戻しシステムのために非常に重要です。 2024年以来、SanofiやMylanなどの企業による複数のバイオシミラーインシュリンアナログの打ち上げは治療オプションを拡大し、治療コストを大幅に削減しました。 好ましいFDAの方針は市場の競争および革新を促進する生物類似体の承認を加速しました。 さらに、国内メーカーと国際パートナー間の戦略的コラボレーションにより、サプライチェーンの最適化、市場収益の強化、長期的な成長戦略の支援を行っています。
ドイツ抗糖尿病 バイオシミラー市場分析とトレンド
ドイツの抗糖尿病バイオシミラー市場は、成熟した医療システム、強力な規制支援、および成長したコスト達成への取り組みによって駆動された安定した成長によって特徴付けられます。 バイオシミラー、特にインシュリンのアナログは治療効果を維持している間処置の費用を減らすためにますます採用されます。 払い戻し方針と初期の生体シミラー置換プログラムが医師と患者の摂取を促す。 市場拡大は、競争力のあるバイオシミラーポートフォリオと継続的な研究開発投資を立ち上げた医薬品選手によってサポートされています。 病院および小売薬局は主要な配分チャネルを維持します。 糖尿病管理のための治療薬を含む持続可能な取り組みとデジタル健康統合は、徐々に市場のダイナミクスを影響し、ドイツをヨーロッパの安定したまだ革新的なバイオシミラー市場として位置付けています。
アナリストオピニオン
アジア・パシフィックと北米における糖尿病の高まりの発生率は、インドと中国では、2024年から2026年にかけて診断された症例の18%増加を報告し、高度の輸入および地方製造業を運転し、治療ニーズを満たし、市場収益を増加させました。
組換え DNA 技術および合理化されたバイオシミラーの承認プロセスの進歩は生産の効率を改善しました。 バイオシミラーインシュリンのアナログは2025年の生産能力の28%の全体的な増加を見ましたり、競争価格および拡大の市場シェアを可能にします。
病院の処方と払い戻しスキームにおけるバイオシミラーの採用は、進化する市場ダイナミクスを反映しています。 EU諸国は、2024年の間に国民の償還リストにバイオシミラー含有量が24%増加し、アクセシビリティを向上させ、新しい治療アプリケーションを有効にします。
大手バイオ医薬品の特許調査による価格圧力が市場浸透を加速しました。 米国では、2024年後半から、複数のバイオシミラーインシュリングルガインが発売され、平均35%で価格が低下し、成長戦略のシフトを促し、持続的な拡張をサポートする業界動向を明らかにしました。
市場規模
| レポートカバレッジ | ニュース | ||
|---|---|---|---|
| 基礎年: | 2025年 | 2026年の市場規模: | 米ドル 5.8 資本金 百万円 |
| 履歴データ: | 2020年~2024年 | 予測期間: | 2026 へ 2033 |
| 予測期間 2026〜2033 CAGR: | 12.5%の | 2033年 価値の投射: | 1億米ドル |
| 覆われる幾何学: |
| ||
| カバーされる区分: |
| ||
| 対象会社: | Novo Nordisk、Biocon、Sanofi、Eli Lilly、Pfizer、Sandoz、Dr。 Reddyの研究所、Samsung Bioepis、Wockhardt、Zydus Cadila | ||
| 成長の運転者: |
| ||
75 以上のパラメータで検証されたマクロとミクロを明らかにする, レポートにすぐにアクセス
抗糖尿病バイオシミラー市場成長因子
成長する世界的な糖尿病人口、特に新興国では、抗糖尿病性バイオシミラー市場成長の重要なドライバーとして機能します。 バイオシミラーの生産の効率および参照の生物的学のパテントのexpirationsによって燃料を供給される増加された有価性は都市中心を越えて、アクセスを広げました。 規制調和と組み合わせて、バイオロジカル製造における技術的進歩は、市場参入障壁を下げ、メーカーは急速に規模を拡大することができます。 また、アジア・太平洋を越えた医療インフラの整備や改善など、バイオシミラーの採用を加速しています。 これらの要因は、高収益化、より広い患者のアクセシビリティ、および開発および新興地域の持続的な拡大をサポートする、強力な市場成長力を強化します。
抗糖尿病バイオシミラー市場開発
初期に**2025 米国食品医薬品局認定メリログ(インシュリンアスパルツジ)、最初の急速作用インシュリンバイオシミラーに ノボログ、インシュリン治療オプションを拡張し、インシュリン市場で競争が増加するにつれて糖尿病の人々のための潜在的にコストを削減することにより、抗糖尿病バイオシミラーの重要な進歩を示す。 これは、手頃な価格の生物学的治療へのアクセスを改善することを目的としたバイオシミラーの規制の勢いに基づいて構築します。
もう一つの重要な開発は、中国初のローカル開発バイオシミラーバージョンOzempicです ( )semaglutide)、semaglutideバイオシミラーのための承認を適用する中国の薬剤師と。 承認された場合、この製品は、中国本土で初の希釈バイオシミラーとなり、主要な生物学的アプローチとして、タイプ2糖尿病のよりアクセス可能なGLP-1療法を導入する世界的な努力を反映しています。
キープレイヤー
市場をリードする企業
ノヴォ・ノルディスク
サノフィ
バイオコン
エリ・リリー
パフィイザー
サンダル
レッドディ博士の研究所
サムスンBioepis
ウォックハルト
Zydus カディラ
容量の拡大および戦略的なパートナーシップを含む複数の市場プレーヤーは積極的な成長の作戦を、追求しました。 例えば、バイオコンは、2025年に世界有数の製薬会社と共同で、バイオシミラーインシュリン生産能力を30%増し、マーケットリーチを拡大しました。 同様に、Sanofiのデジタルサプライチェーンソリューションへの投資は、稼働効率を高め、市場での競争力を強化し、リードタイムを15%削減しました。 これらのイニシアチブは、コラボレーションと技術の活用の広範な傾向を反映し、生産を最適化し、アクセシビリティを向上させ、抗糖尿病バイオシミラー市場における成長を持続させます。
抗糖尿病バイオシミラー市場将来の見通し
抗糖尿病性バイオシミラー市場は、増加する糖尿病の優先順位、増加するヘルスケアの支出、および費用効果が大きい処置の選択のための押しによって運転される強い成長のためにpoised。 主要なインスリンおよび生物的療法の特許のexpirationsを経つと、新しいバイオシミラーのentrantsのための機会を開け続けます。 製造技術の進歩、規制調和、デジタルヘルスの統合は、特に新興市場での生産を合理化し、患者のアクセスを高めることが期待されます。 病院、オンライン薬局、政府支援の償還プログラムは、主要な流通チャネルを維持します。 全体的に、市場見通しは肯定的です, 持続的な拡張と, より手頃な価格, そして、世界的な糖尿病管理の未来を形づくバイオシミラーのより広い採用.
抗糖尿病バイオシミラー市場歴史的分析
抗糖尿病性バイオシミラー市場は、過去10年間に安定した成長を経験しました, 糖尿病の上昇の世界的な蔓延と参照の生態学の高コストによって主に駆動. 当初、市場拡大は、先進医療インフラ、強力な規制枠組み、再燃政策がバイオシミラー採用を容易にする、北米や欧州などの先進地域に集中しました。 初期のバイオシミラーインスリンは、治療コストを削減し、患者のアクセスを増加させました。 新興市場では、限られた医療アクセスと規制の複雑さにより成長が遅くなりましたが、認知と政府の取り組みが徐々に採用が向上しました。 全体的に、歴史的な傾向は、費用対効果の高いアクセス可能な糖尿病管理ソリューションへのシフトを反映しています。
ソース
第一次研究 インタビュー:
内分泌科医と糖尿病学者
病院の薬剤師
生態学およびバイオシミラーの臨床研究者
製薬会社役員
データベース:
世界保健機関(WHO)グローバルヘルス展望台
国際糖尿病連盟(IDF)糖尿病アトラス
OECDの特長 健康データ
雑誌:
ファーマタイムズ
医薬品技術
バイオシミラー開発
医薬品事業部
ファース・ファーマ
ジャーナル:
糖尿病ケア
バイオドラッグ
糖尿病、肥満および転移
糖尿病科学技術ジャーナル
内分泌学と代謝における治療上の優位性
新聞:
ニューヨークタイムズ(健康)
ガーディアン(健康)
金融タイムズ(ヘルスケア)
ヒンズー教(健康)
ロイターの健康
協会:
世界保健機関(WHO)
国際糖尿病連盟(IDF)
欧州医薬品庁(EMA)
バイオシミラー医薬品グループ(BMG)
著者について
Ghanshyam Shrivastava - 経営コンサルティングとリサーチの分野で 20 年以上の経験を持つ Ghanshyam Shrivastava は、プリンシパル コンサルタントとして、生物製剤とバイオシミラーに関する幅広い専門知識を持っています。彼の主な専門知識は、市場参入と拡大戦略、競合情報、さまざまな治療カテゴリと API に使用されるさまざまな医薬品の多様なポートフォリオにわたる戦略的変革などの分野にあります。彼は、クライアントが直面する主要な課題を特定し、戦略的意思決定能力を強化するための堅牢なソリューションを提供することに優れています。彼の市場に関する包括的な理解は、リサーチ レポートとビジネス上の意思決定に貴重な貢献をします。
Ghanshyam は、業界カンファレンスで人気の高い講演者であり、製薬業界に関するさまざまな出版物に寄稿しています。
独占トレンドレポートで戦略を変革:
よくある質問


